Михаил Мурашко: «Работа Росздравнадзора стала максимально открытой» №1(90), 2018 год
В одном из последних интервью журналу «Кто есть Кто в медицине» руководитель Федеральной службы по надзору в сфере здравоохранения Михаил Мурашко заметил, что Росздравнадзор призван наполнять реальным смыслом ключевые цели организации здравоохранения, а успешность Службы обусловлена тремя факторами: профессионализмом кадров, широким кругом полномочий и хорошей лабораторной базой. Насколько изменился этот список и какие новые факторы обеспечивают развитие Службы, Михаил Альбертович рассказал нашему корреспонденту.
— Михаил Альбертович, какие направления деятельности для Федеральной службы по надзору в сфере здравоохранения приоритетны сегодня?
— Сегодня происходит реформирование контрольно-надзорной деятельности в целом в Российской Федерации, и Росздравнадзор также сконцентрировался в рамках своих полномочий на нескольких важных направлениях.
Первое — это повышение эффективности контрольно-надзорной деятельности, достижение социально значимых результатов в виде снижения смертности населения, уменьшение нагрузки на поднадзорные субъекты при улучшении качества проверок.
Второе — переход на риско-ориентированный подход в контрольно-надзорной деятельности, а также профилактическая работа с поднадзорными субъектами, актуализация требований и формирование чек-листов для контрольных мероприятий.
Росздравнадзор работает по трём основным направлениям: контроль за качеством оказания медицинской помощи, контроль качества медицинской продукции, в частности лекарственных препаратов, и третий раздел — это качество медицинских изделий.
В рамках формирования риско-ориентированного подхода нами сформировано шесть категорий риска. К организациям, относящимся к чрезвычайно высокому риску, контрольные мероприятия (плановые проверки) будут применяться один раз в календарном году, для высокого риска — один раз в два года, для значительного риска — раз в три года. Для организаций среднего риска — не чаще чем один раз в пять лет, а для учреждений умеренного риска — не чаще чем один раз в шесть лет. На предприятиях с низкой категорией риска плановые проверки проводиться не будут.
Для медицинских организаций будут использованы все шесть категорий риска. Для организаций, осуществляющих деятельность в сфере обращения лекарственных средств, будут применяться только такие категории риска, как значительный, средний, умеренный и низкий. Аналогичная градация будет применяться и к организациям в сфере обращения медицинских изделий: начиная со значительного и заканчивая низким риском.
Ключевыми показателями эффективности и результативности контрольно-надзорной деятельности станут снижение количества смертельных случаев по контролируемым видам риска, снижение числа заболеваний и отравлений пострадавших и травмированных по контролируемым видам риска, а также снижение уровня материального ущерба. В рамках данного проекта формируются показатели по трём видам контроля: по качеству и безопасности медицинской деятельности, по государственному надзору в сфере обращения лекарственных средств, в том числе лицензионных, и государственному контролю за обращением медицинских изделий.
Росздравнадзором сформирован перечень правовых актов и отдельных частей положений, содержащих обязательные требования, соблюдение которых оценивается при проведении контрольных мероприятий в рамках отдельного вида государственного контроля. Также разработаны и проходят утверждение чек-листы для проведения контрольных мероприятий.
Профилактическая деятельность Росздравнадзора будет направлена на предупреждение нарушений обязательных требований: предотвращение риска причинения вреда и снижение уровня ущерба, устранение причин и условий, способствующих нарушению обязательных требований, формирование социально ответственного добросовестного правового поведения среди подконтрольных субъектов, повышение прозрачности контрольно-надзорной деятельности и снижение административной нагрузки.
В рамках данной работы нами размещены на официальных сайтах в сети Интернет перечни нормативно-правовых актов. Ежеквартально каждым территориальным органом и центральным аппаратом Росздравнадзора проводятся публичные мероприятия для информирования юридических лиц и индивидуальных предпринимателей по вопросам соблюдения обязательных требований. Ежегодно обобщается практика осуществления надзора, или так называемый формат «как делать нельзя», и практика направления предостережений о недопустимости нарушения обязательных требований.
— Какие другие меры будут направлены на повышение качества медицинской помощи россиянам?
— Сегодня в рамках государственного контроля мы опираемся на положения 323-го Федерального закона «Об основах охраны здоровья граждан Российской Федерации». Качество медицинской помощи включает в себя своевременность её оказания, правильность выбора методов профилактики, диагностики, лечения, реабилитации и степень достижения запланированного результата. Таким образом, сегодня в вопросах качества является необходимой процедурой стандартизация медицинской помощи, которая состоит из основных трёх компонентов: стандартизации структуры, процесса и результата. В рамках данной деятельности Минздравом России разработаны и утверждены порядки и правила оказания медицинской помощи — унифицированные требования к условиям её оказания.
Разработано более 1200 клинических рекомендаций, которые охватывают все основные классы заболеваний: более 90 % основных нозологических форм и более 6000 моделей пациентов с учётом тяжести и особенностей лечения.
Также используются стандарты медицинской помощи, методы оплаты по клинико-статистическим группам, что является основой стоимости для оказания медицинской помощи. Министерством здравоохранения утверждены приказы по положению об организации оказания первичной медико-санитарной помощи в целях приближения таковой к месту проживания населения; требования к размещению медицинских организаций государственной и муниципальной системы здравоохранения, исходя из потребностей. Таким образом, сегодня уровень стандартизации в здравоохранении очень высок. С учётом выхода приказов Министерства здравоохранения РФ о критериях качества оказания медицинской помощи (в частности, это приказ 203-М от 10.05.2017 № 203н «Об утверждении критериев оценки качества медицинской помощи») критерии оценки качества медицинской помощи формируются по группам заболеваний или состояниям на основе соответствующих порядков оказания медицинской помощи, стандартов медпомощи и клинических рекомендаций.
В июле 2017 года вступили в действие изменения в 323-й Федеральный закон, которые позволяют вести электронные истории, выписывать рецепты в электронном виде и т.д. То есть сегодня создана система для внедрения электронного бенчмаркинга в здравоохранении. Подумайте только: ежегодно 30 миллионов жителей нашей страны получают стационарную медицинскую помощь и более 120 миллионов — амбулаторно-поликлиническую помощь. Это огромные показатели. Для того чтобы создать систему контроля качества оказания медицинской помощи, всем необходимо переходить на новые формы работы, в частности на формирование электронных ресурсов.
Переломным моментом, который позволит нам двигаться в этом направлении, является внесение изменений в 323-й Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» о формировании единой государственной информационной системы в сфере здравоохранения, которая объединит в себе нормативно-справочную информацию, федеральные базы данных и федеральные регистры в сфере здравоохранения.
Создание такого инструмента позволит нам эффективно оценивать огромное количество информации, вступить в новую веху «данных реальной клинической практики», получать на основе этих данных реальные клинические доказательства эффективности и безопасности, что в итоге выведет оценку качества медицинской помощи на принципиально новый уровень.
Таким образом, основные меры будут направлены на реализацию вышеуказанных нормативно-правовых документов, для того чтобы контроль за качеством оказания медицинской помощи приобрёл более системный формат.
— Борьба с контрафактом — острая проблема фармацевтической отрасли России, требующая конкретных решений. Каковы возможности минимизации рисков?
— В настоящее время в рамках исполнения поручения президента Российской Федерации реализуется пилотный проект по маркировке лекарственных препаратов контрольно-идентификационными знаками — от производителя до конечного получателя. Мы оцениваем сегодня течение пилотного проекта как штатный процесс. Уже получены первые положительные результаты по внедрению маркировки лекарственных препаратов, которые позволили государству только в 2017 году выявить правонарушений почти на 100 миллионов рублей.
Мы считаем, что данная система позволит полностью застраховать население от недоброкачественных, фальсифицированных и контрафактных лекарственных препаратов при полной её реализации к 2020 году. Государственной думой РФ в конце декабря прошлого года принят закон о внедрении маркировки, подготовлен проект постановления по реализации данного проекта. Сегодня идёт подключение аптечных и медицинских организаций к разработанной системе маркировки. Данный проект параллельно с нами реализуют такие страны, как Бразилия, США, Китай, Аргентина, государства Евросоюза, и он уже показывает свою эффективность.
В Российской Федерации, находящейся в общемировом тренде по данному направлению, столь глобальный проект должен быть реализован, и его результаты дадут повышение качества лекарственной терапии в целом для населения. Каждый житель нашей страны сможет убедиться в подлинности и легальном обороте любого лекарственного препарата, находящегося на аптечных полках или в медицинских организациях, с помощью мобильного приложения.
Также необходимо отметить, что возможности системы мониторинга движения лекарственных препаратов позволяют дополнительно использовать её для целей фармаконадзора, планирования и управления запасами лекарственных препаратов на всех уровнях.
— Расскажите об участии Федеральной службы по надзору в сфере здравоохранения в государственных программах и проектах федерального уровня.
— В первую очередь хотелось бы отметить, что в заключительной стадии находится реализация проекта по строительству лаборатории по контролю качества лекарственных средств в городе Ярославле. Он реализуется в рамках программы «Фарма-2020», данная лаборатория планируется к запуску в 2018 году. Параллельно мы приступаем к реорганизации и капитальному ремонту лаборатории в Санкт-Петербурге, которая будет также включать в себя новый блок для данного региона — по контролю качества иммунобиологических препаратов, и впервые в нашей стране мы формируем в лаборатории блок по контролю качества биомедицинских клеточных продуктов.
— В числе приоритетных направлений развития Федеральной службы по надзору в сфере здравоохранения на 2017 год заявлено повышение публичности и открытости деятельности. Насколько доступна информация о проводимых контрольно-надзорных мероприятиях и их результатах?
— Сегодня каждая проверка становится прозрачной, вся информация находится в едином реестре проверок на сайте Генеральной прокуратуры РФ, где можно ознакомиться с результатами ранее проведённых контрольных мероприятий и планах проверок на текущий год.
Я уже упоминал риско-ориентированный подход при проведении проверок и градации всех организаций в зависимости от класса риска. Так вот, сегодня каждая организация, осуществляющая фармацевтическую или медицинскую деятельность, может найти на нашем сайте информацию о присвоенной ей категории риска и, соответственно, обратиться за разъяснением к нам в случае возникновения разногласий по данному вопросу.
Публичные мероприятия, о которых я также упоминал, сегодня транслируются в онлайн-режиме в сети Интернет, а их видеозаписи также доступны в формате видеороликов, презентаций и т.д.
Сегодня вся деятельность Росздравнадзора максимально открыта: это и функционирование горячих линий, и личные приёмы граждан, и разъясняющие материалы, и открытые письма, и методические рекомендации для рынка. Работа Федеральной службы по надзору в сфере здравоохранения стала максимально прозрачной, и мы готовы к сотрудничеству и обсуждению наиболее важных проблем для отрасли.
— Михаил Альбертович, подводя черту, что бы вы хотели сказать нашим читателям в начале наступившего 2018 года?
— В новом году хотелось бы пожелать всем здоровья, успехов и, безусловно, процветания нашей стране.
Росздравнадзор: цифры и факты
МЕДИЦИНСКИЕ ИЗДЕЛИЯ
В рамках государственного контроля за обращением медицинских изделий на 1 декабря 2017 года предотвращено обращение более 1 миллиона единиц медицинских изделий, не соответствующих установленным требованиям. По результатам совместных контрольных мероприятий Росздравнадзора, МВД России, СК России за 9 месяцев 2017 года возбуждено 79 дел по ст. 238.1 УК РФ «Обращение фальсифицированных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и оборот фальсифицированных биологически активных добавок».
МАРКИРОВКА ЛЕКАРСТВ
Проект по маркировке является всеобъемлющим для контроля качества, чтобы каждый потребитель смог убедиться, что препарат находится в обороте легально. Создан программный продукт для производителей, дистрибьюторов, аптечных организаций, к системе подключено более 1000 участников и 52 лекарственных препарата.
Использование маркировки на этапе эксперимента позволило выявить преступления в сфере обращения лекарственных средств на сумму более чем 100 млн рублей. Возбуждены уголовные дела, ведётся следствие.
Разработано и внедрено приложение для смартфонов «Проверка маркировки товаров», доступное на Google Play и в App Store. Сегодня с его помощью можно проверить качество лекарств, подключенных к пилотному проекту.
В Российской Федерации создана качественная система государственного контроля лекарственных средств. Испытания лекарственных средств проводятся в двенадцати современных лабораторных комплексах Росздравнадзора, расположенных во всех федеральных округах. Наиболее крупные из них прошли переквалификацию ВОЗ и вошли в Официальную сеть лабораторий (OMCL) Европейского директората по качеству медицинской продукции (EDQM). В 2017 году общая мощность лабораторий позволила в два раза (по сравнению с 2015 годом) увеличить количество проводимых экспертиз — до 33 тысяч.
Увеличение количества экспертиз наряду с введением Правил надлежащей производственной практики и проведением мероприятий по контролю за производством лекарственных средств, впервые за последние пять лет позволили в 2017 году снизить количество недоброкачественных и фальсифицированных лекарственных средств на фармацевтическом рынке России практически в два раза.
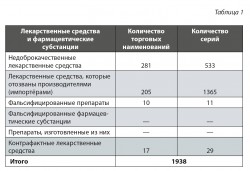
Информация о результатах государственного контроля (надзора) в сфере обращения лекарственных средств за 2016 год
В результате проведённых Росздравнадзором мероприятий за 2016 год было изъято из обращения 1938 серий лекарственных средств, качество которых не отвечает установленным требованиям, что составляет 0,81 % от общего количества серий, поступивших в обращение в 2016 году (по данным АИС Росздравнадзора, 237 968 серий).
Сведения о количестве изъятых из обращения лекарственных средств в 2016 году представлены в табл. 1.
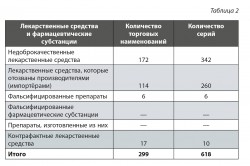
Информация о результатах государственного контроля (надзора) в сфере обращения лекарственных средств за 9 месяцев 2017 года
В результате проведённых Рос-здравнадзором мероприятий за 9 месяцев 2017 года всего было изъято из обращения 618 серий лекарственных средств, качество которых не отвечает установленным требованиям (табл. 2).




 8(495)258-97-03
8(495)258-97-03 